A Agência Nacional de Vigilância Sanitária (Anvisa) acaba de aprovar o Libtayo®, nome comercial da molécula cemiplimabe, para o tratamento de pacientes com carcinoma basocelular (CBC) localmente avançado ou metastático previamente tratado com inibidor da via Hedgehog ou para os quais um inibidor da via Hedgehog não é adequado.
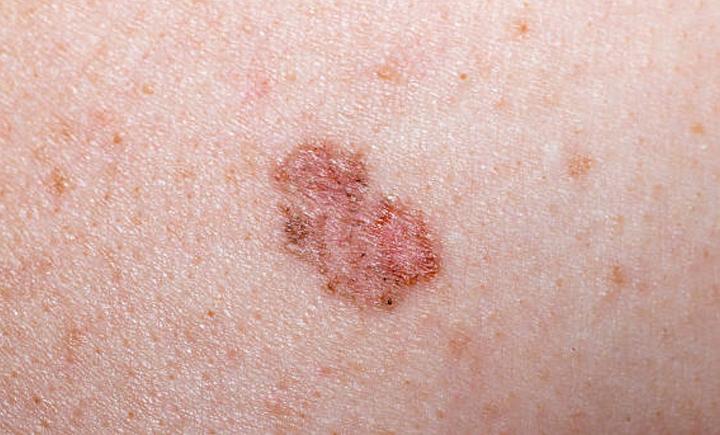
De acordo com o INCA, estima-se 177 mil novos casos de câncer de pele não melanoma por ano3, dos quais ~80% são basocelulares1. O CBC se origina nas células basais, presentes na camada mais profunda da epiderme e ele pode se tornar avançado e agressivo em 1% dos casos4.
“Embora a grande maioria dos carcinomas basocelulares seja detectada precocemente e curada com cirurgia, uma pequena proporção dos tumores pode se tornar avançada e penetrar profundamente nos tecidos circundantes, se tornando localmente avançado, ou disseminar na forma de metástase”, destaca Suely Goldflus4.
O Brasil é o segundo país a registrar o medicamento, que já foi aprovado pela Food and Drug Administration (FDA), nos Estados Unidos, em fevereiro desse ano, onde foi classificado como breakthrough therapy para pacientes com carcinoma espinocelular de pele avançado. A designação breakthrough therapy foi criada pelo FDA para agilizar o desenvolvimento e a revisão de medicamentos desenvolvidos para condições graves ou com risco de vida.
Carcinoma basocelular
Na maioria das vezes, o CBC atinge os locais do corpo mais expostos ao sol, como face e pescoço, causando um forte impacto emocional na vida do paciente1. Entre os fatores de risco para desenvolvimento da doença, além da exposição excessiva ao sol e aos raios ultravioletas, destaca-se a idade avançada1.
Libtayo®, que chega para suprir uma necessidade médica não atendida, será comercializado pela Sanofi Genzyme, a unidade de negócios da Sanofi focada em soluções para doenças de alta complexidade, entre elas, oncologia. O medicamento é um anticorpo monoclonal que impede a ligação da célula tumoral ao linfócito T (célula de defesa), restabelecendo, assim, a capacidade de defesa desse linfócito e, portanto, do sistema imune.
Desde 2019, a molécula cemiplimabe está aprovada para o tratamento de carcinomas espinocelulares da pele localmente avançados ou metastáticos que não sejam candidatos à cirurgia ou radioterapia, um outro tipo de câncer de pele não melanoma, até então sem opção de tratamento medicamentoso.
Libtayo® foi desenvolvido pela Sanofi em conjunto com a Regeneron, em um acordo global de colaboração.
Estudos clínicos
A segurança e eficácia de cemiplimabe para o tratamento de CBC foram estabelecidas em um estudo aberto, multicêntrico, não randomizado e que representa o maior ensaio clínico entre essa população de pacientes.
Sobre a Sanofi Genzyme
A inovação para a ciência é um dos pilares da Sanofi Genzyme, a unidade de negócios global de doenças de alta complexidade da Sanofi, focada em cinco áreas: doenças raras, esclerose múltipla, oncologia, imunologia e doenças raras do sangue.
Dedicada a transformar os novos conhecimentos científicos em soluções para os desafios de saúde, com tratamentos para doenças normalmente difíceis de diagnosticar e caracterizadas como necessidades médicas não atendidas, a Sanofi Genzyme foi a primeira a desenvolver terapia de reposição enzimática para doenças de armazenamento lisossômico (LSDs).
Fundada como Genzyme em Boston (Estados Unidos) em 1981, rapidamente cresceu para se tornar uma das principais empresas de biotecnologia do mundo. A Genzyme tornou-se parte da Sanofi em 2011.
Referências
- Chinem VP et al. Epidemiologia do carcinoma basocelular. An Bras Dermatol. 2011;86(2):292-305.
- American Cancer Society. What are Basal and Squamous Cell Skin Cancers? https://www.cancer.org/cancer/
basal-and-squamous-cell-skin- cancer/about/what-is-basal- and-squamous-cell.html (accessed Feb 03, 2020) - Instituto Nacional de Câncer José Alencar Gomes da Silva. Estimativa 2020 : incidência de câncer no Brasil / Instituto Nacional de Câncer José Alencar Gomes da Silva. – Rio de Janeiro : INCA, 2019.
- Mohan SV, et al.. Advanced Basal Cell Carcinoma: Epidemiology and Therapeutic Innovations Curr Dermatol Rep. 2014 Feb 9;3:40-45